PJA ニュースレター No.14
構造生物学を激変させたクライオ電子顕微鏡法
東京医科歯科大学 藤吉 好則
構造生物学は、医学・薬学、基礎生物学などの分野で使われる構造情報を提供する。また、2000年から始まったEvidence-Based Drug Developmentにより構造創薬が注目されるようになった。しかし、膜タンパク質や複雑な分子の構造解析は、容易ではなかった。この状況が、クライオ電子顕微鏡を用いた単粒子解析法の発展によって激変した。
基本となる単粒子解析用のコンピュータプログラムは1981年に開発され改良されてきた。非晶質の氷に包埋する急速凍結法が1984年に開発された。絶対温度4Kに試料を冷却して高分解能像を撮影できるクライオ電子顕微鏡を1986年に開発した。近年、電子線を直接検出できる高性能のカメラシステムが開発され、2013年に辛みや温度感受性のチャネルTRPV1の構造が解析された。これを嚆矢として、単粒子解析法による構造が次々発表されるようになり、構造解析数が年間4,000を超えるようになった。すなわち、複雑な分子でも精製できれば、構造解析が可能になった。最近、人工知能を用いてタンパク質の構造を予測するプログラム(AlphaFold)が開発さ れた。これを用いて作製した構造モデルを、クライオ電子顕微鏡で解析した密度図に当てはめ、正しくない構造部分を実際の密度図に合うように改変することで、極めて短期間に立体構造が解析できるようになった。
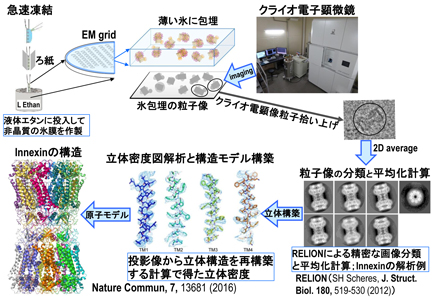
単粒子解析法は図に示すような流れで解析する。1)標的分子を精製し、膜タンパク質の界面活性剤を何らかの方法で除く。2)試料を最適な厚さの氷に包埋してクライオ電子顕微鏡像を撮影する。通常1日で数千枚の像を自動撮影できる。3)解析プログラムを用いることで、粒子像を自動で拾い上げるが、1日の撮影画像で数十万粒子~百万粒子程度を拾い上げることができる。4)拾い上げた像を、何種類かの異なる構造が存在すると仮定して、解析プログラムRELIONなどによりクラス分けを行い、同一構造に分類した2次元平均像を計算する。5)それらから立体再構成する解析法で、3次元の密度図が計算できる。6)その密度図とアミノ酸配列の情報を用いて、原子モデルを作製する。
図の例で示すギャップ結合チャネルは、発生制御や、炎症、細胞死、免疫応答、筋収縮などに関わっている細胞間をつなぐチャネルで、脊椎動物にはコネキシンが、無脊椎生物にはイネキシンが発現して、ギャップ結合を形成している。このイネキシンは、長年努力しても結晶学では解析できなかったが、単粒子解析法によって、高い分解能での構造をわずか2か月で解析できた。ギャップ結合は大きな可溶性分子を透過できるが、複雑なゲーティング機構で制御されるとともに、速いゲーティング制御も行っている。単粒子解析法を用いることで、構造解析できなかった標的分子の構造情報が短期間で得られるようになったこの例のように、様々なタンパク質やその複合体の構造解析が飛躍的に進むようになっている。